Vol. 151, no 4 — Le 22 février 2017
Enregistrement
DORS/2017-18 Le 13 février 2017
LOI SUR LES ALIMENTS ET DROGUES
LOI RÉGLEMENTANT CERTAINES DROGUES ET AUTRES SUBSTANCES
Règlement correctif visant certains règlements (ministère de la Santé)
C.P. 2017-113 Le 13 février 2017
Sur recommandation de la ministre de la Santé, Son Excellence le Gouverneur général en conseil prend le Règlement correctif visant certains règlements (ministère de la Santé), ci-après, en vertu :
- a) du paragraphe 30(1) (voir référence a) de la Loi sur les aliments et drogues (voir référence b);
- b) du paragraphe 55(1) (voir référence c) de la Loi réglementant certaines drogues et autres substances (voir référence d).
Règlement correctif visant certains règlements (ministère de la Santé)
Loi sur les aliments et drogues
Règlement sur les aliments et drogues
1 L’article A.01.042 de la version anglaise du Règlement sur les aliments et drogues (voir référence 1) est remplacé par ce qui suit :
A.01.042 If an inspector examines or takes a sample of a food or drug under section A.01.041, the inspector may submit it to an analyst for analysis or examination.
2 L’article A.01.043 du même règlement est remplacé par ce qui suit :
A.01.043 L’inspecteur qui estime, après examen d’un échantillon de l’aliment ou de la drogue ou réception du rapport de l’analyste, que la vente de l’aliment ou de la drogue au Canada serait contraire à la Loi ou au présent règlement en avise par écrit le percepteur des douanes ainsi que l’importateur.
3 Les alinéas B.14.007a) et b) de la version française du même règlement sont remplacés par ce qui suit :
- a) lorsqu’il est vendu pour servir dans les viandes conservées et dans les sous-produits de viande conservés, il peut renfermer de l’acide ascorbique, de l’acide érythorbique, de l’acide isoascorbique, de l’ascorbate de calcium, de l’ascorbate de sodium, du carbonate de sodium, de l’érythorbate de sodium, de l’iso-ascorbate de sodium, du nitrate de potassium, du nitrite de potassium, du nitrate de sodium ou du nitrite de sodium, pourvu que ces nitrates et nitrites, le cas échéant, soient emballés séparément des épices et condiments;
- b) lorsqu’il est vendu pour servir dans la viande préparée ou dans les sous-produits de viande dans lesquels il est permis d’ajouter un agent gélatinisant, il peut renfermer un tel agent gélatinisant;
4 Le passage de l’article B.14.009 de la version française du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
B.14.009 La marinade, la saumure et le mélange de salaison à sec employés dans le marinage des viandes conservées et des sous-produits de viande conservés peuvent renfermer
5 Le passage de l’article B.14.031 de la version française du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
B.14.031 La viande conservée et les sous-produits de viande conservés sont faits de viande crue ou cuite ou d’un sous-produit de viande crue ou cuite, qui ont été salés, asséchés, marinés, saumurés ou fumés et peuvent être garnis d’une glace et renfermer
6 L’alinéa B.21.003b) de la version française du même règlement est remplacé par ce qui suit :
- b) s’il est congelé, être enrobé d’une glaçure se composant d’eau, de monoglycérides acétyles, de chlorure de calcium, d’alginate de sodium, de carboxyméthycellulose de sodium, de phosphate disodique, de sirop de maïs, de dextrose, de glucose, de solides du glucose, d’acide ascorbique ou de son sel de sodium, ou d’acide érythorbique ou de son sel de sodium;
7 Le passage de l’article B.21.005 de la version française du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
B.21.005 Le poisson, à l’exception des protéines de poisson, les produits de chair ou leurs préparations sont falsifiées si l’une des substances ci-après ou une substance de l’une des catégories ci-après s’y trouve ou y a été ajoutée :
8 Le passage de l’article B.21.006 du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
B.21.006 Le poisson et la chair préparés doivent être l’aliment entier ou haché préparé à partir du poisson ou de la chair, selon le cas, frais ou conservé; ils peuvent être cuits ou en conserve et peuvent,
9 L’alinéa B.21.006n) de la version française du même règlement est remplacé par ce qui suit :
- n) dans le cas d’un mélange de poisson et de chair préparés qui a l’apparence et le goût de la chair d’animaux marins ou d’animaux d’eau douce, contenir du remplissage, un liant à poisson, de l’œuf entier, du blanc d’œuf, du jaune d’œuf, un colorant alimentaire, des agents gélatinisants ou stabilisants, des agents modifiant la texture, des préparations aromatisantes naturelles, des préparations aromatisantes artificielles, des agents rajusteurs du pH, de l’édulcorant et, dans une proportion ne dépassant pas deux pour cent du mélange, des légumineuses;
10 L’article B.21.007 de la version française du même règlement est remplacé par ce qui suit :
B.21.007 Le liant à poisson devant servir dans ou sur le poisson ou la chair préparés doit être du remplissage auquel on a ajouté n’importe quel mélange de sel, de sucre, de dextrose, de glucose, d’épices ou d’autres condiments.
11 Le passage de l’article B.21.021 de la version française du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
B.21.021 Le poisson conservé et la chair conservée doivent être du poisson ou de la chair, à l’état cru ou cuit, qui ont été desséchés, salés, marinés, saumurés ou fumés; ils peuvent renfermer un agent de conservation de la catégorie I, un agent de conservation de la catégorie II, du dextrose, du glucose, des épices, du sucre et du vinaigre, et :
12 Le passage de l’article B.22.021 de la version française du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
B.22.021 La viande de volaille conservée et les sous-produits de viande de volaille conservés sont de la viande de volaille ou des sous-produits de viande de volaille crus ou cuits, qui ont été salés ou fumés et qui peuvent renfermer :
13 L’article C.01.009 du même règlement est remplacé par ce qui suit :
C.01.009 Lorsqu’une loi fédérale ou un de ses règlements fixe une norme de composition ou de qualité pour une drogue et y donne un nom ou une désignation, il est interdit de faire figurer ce nom ou cette désignation sur l’étiquette ou dans la publicité de la drogue, à moins que celle-ci ne soit conforme à la norme de composition ou de qualité.
14 (1) Le paragraphe C.01.019(2) de la version française du même règlement est remplacé par ce qui suit :
(2) Le rapport comprend une analyse critique et concise des réactions indésirables à la drogue et des réactions indésirables graves à la drogue, ainsi que les fiches d’observation portant sur toutes les réactions indésirables à la drogue et les réactions indésirables graves à la drogue — ou celles qui sont précisées par le ministre — qui sont connues du fabricant et qui sont associées au sujet de préoccupation que le ministre a demandé à celui-ci d’analyser dans le rapport.
(2) Le paragraphe C.01.019(3) du même règlement est remplacé par ce qui suit :
(3) Après avoir donné au fabricant la possibilité de se faire entendre, le ministre précise un délai raisonnable, selon les circonstances, pour la présentation du rapport. Ce délai ne peut être de moins de trente jours que si le ministre a besoin des renseignements contenus dans le rapport pour établir si la drogue présente un risque grave et imminent pour la santé humaine.
15 L’alinéa C.01A.013a) du même règlement est remplacé par ce qui suit :
- a) la modification des renseignements visés aux alinéas C.01A.005a), b) et e) à i);
16 Le paragraphe C.05.014(3) du même règlement est remplacé par ce qui suit :
(3) Les articles C.01.016 à C.01.020 ne s’appliquent pas aux drogues destinées à un essai clinique.
17 Dans les passages ci-après du même règlement, « déchiquetés » est remplacé par « hachés » :
- a) l’alinéa B.21.006s);
- b) l’alinéa B.21.021e).
18 Dans les passages ci-après de la version française du même règlement, « produit du mélange et du malaxage » est remplacé par « produit du râpage et du mélange » :
- a) les sous-alinéas B.08.040(1)a)(i) et (ii);
- b) le sous-alinéa B.08.041(1)a)(i);
- c) le sous-alinéa B.08.041.1(1)a)(i);
- d) le sous-alinéa B.08.041.2(1)a)(i);
- e) le sous-alinéa B.08.041.3(1)a)(i);
- f) le sous-alinéa B.08.041.4(1)a)(i);
- g) les sous-alinéas B.08.041.5(1)a)(i) et (ii);
- h) le sous-alinéa B.08.041.6(1)a)(i);
- i) le sous-alinéa B.08.041.7(1)a)(i);
- j) le sous-alinéa B.08.041.8(1)a)(i).
19 Dans les passages ci-après de la version française du même règlement, « hachée finement » est remplacé par « hachée » :
- a) l’article B.14.033;
- b) l’article B.14.035;
- c) l’alinéa B.14.037(1)a).
20 Dans les passages ci-après de la version française du même règlement, « chair de poisson » est remplacé par « chair » :
- a) le sous-alinéa B.21.005b)(ii);
- b) le passage de l’article B.21.020 précédant l’alinéa a);
- c) l’alinéa B.21.021c).
21 Dans les passages ci-après de la version française du même règlement, « trouble » est remplacé par « désordre » :
- a) l’article C.01.010;
- b) les sous-alinéas C.01.040.3a)(i) et (ii).
Règlement sur les instruments médicaux
22 L’article 5 du Règlement sur les instruments médicaux (voir référence 2) est remplacé par ce qui suit :
5 Sont exemptés de l’application du présent règlement les réseaux de canalisations de gaz médicaux qui sont assemblés sur les lieux d’un établissement de santé et fixés à demeure sur sa structure.
Règlement modifiant le Règlement sur les aliments et drogues (étiquetage, emballage et marques nominatives des drogues pour usage humain)
23 L’article 5 du Règlement modifiant le Règlement sur les aliments et drogues (étiquetage, emballage et marques nominatives des drogues pour usage humain) (voir référence 3) est modifié par remplacement du passage du paragraphe C.01.004.02(4) précédant l’alinéa a) qui y est édicté par ce qui suit :
(4) Dans le cas où la composition de la drogue varie de lot en lot relativement à ses ingrédients non médicinaux :
Loi réglementant certaines drogues et autres substances
Règlement sur les stupéfiants
24 L’article 28 du Règlement sur les stupéfiants (voir référence 4) est remplacé par ce qui suit :
28 Il est interdit au distributeur autorisé de vendre ou de fournir un stupéfiant autre qu’une préparation visée à l’article 36, à moins que ce stupéfiant ne soit solidement emballé et que son contenant immédiat ne soit scellé de telle manière qu’il soit impossible de l’ouvrir sans briser le sceau.
25 Les alinéas 59(4)a.1) et a.2) du même règlement sont remplacés par ce qui suit :
- a.1) il a effectué une opération visée à l’article 7 du Règlement sur l’accès au cannabis à des fins médicales à l’égard d’une personne qui n’est pas soumise à ses soins professionnels;
- a.2) il a contrevenu aux articles 8 ou 9 de ce règlement;
Règlement sur l’accès au cannabis à des fins médicales
26 L’article 88 du Règlement sur l’accès au cannabis à des fins médicales (voir référence 5) est remplacé par ce qui suit :
88 Dans le cas de marihuana fraîche ou séchée, d’huile de chanvre indien ou de graines ou de plants de marihuana destinés à être vendus ou fournis à un client ou à toute personne physique responsable de ce dernier, les renseignements visés aux articles 84, 85 ou 86 et ceux visés à l’alinéa 87(1)a) ou aux paragraphes 87(2) ou (3), selon le cas, peuvent figurer sur la même étiquette.
27 Le passage du paragraphe 90(1) du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
90 (1) Tous les renseignements qui doivent figurer sur une étiquette conformément aux articles 84, 85 ou 86 et à l’alinéa 87(1)a) ou aux paragraphes 87(2) ou (3), selon le cas, sont :
Entrée en vigueur
28 Le présent règlement entre en vigueur à la date de son enregistrement.
RÉSUMÉ DE L’ÉTUDE D’IMPACT DE LA RÉGLEMENTATION
(Ce résumé ne fait pas partie du Règlement.)
Enjeux
Santé Canada (le Ministère) et le Comité mixte permanent d’examen de la réglementation (CMPER) ont relevé divers éléments nécessitant des modifications mineures au Règlement sur les aliments et drogues (RAD), au Règlement sur les instruments médicaux (RIM) et au Règlement sur les stupéfiants (RS). Le CMPER a notamment indiqué qu’un paragraphe redondant du RS devait être abrogé. Santé Canada a également relevé des erreurs de numérotation dans certaines dispositions du Règlement sur l’accès au cannabis à des fins médicales (RACFM), qui doivent elles aussi être corrigées.
Ces modifications, qui sont présentées par le ministère de la Santé, ont été regroupées dans le présent résumé de l’étude d’impact de la réglementation (RÉIR).
Objectif
Les modifications visent à :
- corriger des erreurs dans les numéros de renvoi vers des dispositions;
- corriger des divergences entre les versions anglaise et française;
- harmoniser les termes utilisés dans la réglementation avec ceux utilisés dans la loi habilitante;
- clarifier des dispositions réglementaires;
- corriger des erreurs typographiques ou grammaticales;
- abroger des dispositions réglementaires désuètes, caduques ou redondantes.
Description
Modifications au RAD :
1. Corriger des erreurs typographiques ou grammaticales :
- B.14.033, B.14.035 et B.14.037(1)a) : « hachée finement » sera changé pour « hachée » au temps de verbe approprié.
- Dans la partie B, les termes « preserve », « preserved » et « preserves » sont employés au total 145 fois en référence à la viande, à la volaille et aux produits marins et d’eau douce (par exemple les poissons). Le Ministère a examiné la version française pour déterminer si, dans chaque cas, le bon temps de verbe de « conserver » était utilisé. Dans huit dispositions, les traductions se sont révélées incorrectes et seront changées pour le temps de verbe approprié.
- B.21.002d) : La grammaire inexacte du terme « animaux marine » en français sera changée pour « animaux marins ».
2. Clarifier des dispositions réglementaires :
- C.01.019(3) : Cette disposition sera modifiée par l’ajout du mot « only » dans la version anglaise et des mots « ne […] que » dans la version française pour clarifier l’intention.
- C.01.004.02(4) : Cette disposition sera modifiée pour clarifier l’objet de la disposition en ajoutant le texte en caractères gras dans les versions anglaise et française : « Dans le cas où la composition de la drogue varie de lot en lot relativement à ses ingrédients non médicinaux ».
3. Harmoniser les termes utilisés dans le Règlement avec ceux utilisés dans la loi habilitante :
- C.01.010 et C.01.040.03a) : Dans la version française, le mot « trouble » sera remplacé par « désordre » pour l’harmoniser avec la terminologie de la Loi sur les aliments et drogues.
4. Corriger des divergences entre les versions anglaise et française notées par le CMPER :
- B.08.040 à B.08.041.8 : La traduction française de « product made by comminuting and mixing » (actuellement « produit du mélange et du malaxage ») sera remplacée par « produit du râpage et du mélange ».
- B.21.006[S], B.21.006s) et B.21.021e) : Dans tous les cas où il est question de poisson ou de fruits de mer, le terme « comminuted » sera changé pour « minced » et « déchiquetés » sera remplacé par « hachés ». Pour toute autre denrée alimentaire, ces termes resteront tels quels. Cette modification cadre avec l’abrogation du terme « comminuted » dans le Règlement sur l’inspection du poisson de l’Agence canadienne d’inspection des aliments et fera en sorte que le même terme (haché) sera utilisé dans la traduction française pour traduire « comminuted » et « minced ».
- Conformément à l’interprétation du Ministère selon laquelle « meat » correspond à « chair » en français lorsqu’il est question de produits d’animaux marins et d’animaux d’eau douce :
- B.21.005b)(ii), B.21.020, B.21.021, B.21.021c) : « chair de poisson » sera remplacé par « chair ».
- B.21.006[S], B.21.006(n), B.21.007[S] : « viande » sera remplacé par « chair ».
- C.01.019(2) : Le texte en français « tout ou partie des réactions indésirables » sera modifié afin qu’il corresponde mieux à l’anglais « all or specified adverse drug reactions ».
5. Corriger des divergences entre les versions française et anglaise notées par Santé Canada :
- A.01.043 : Sera modifié comme suit :
- (EN)
 If an inspector, upon examination of a sample of a food or drug
If an inspector, upon examination of a sample of a food or drug 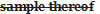 or on receipt of a report of an analyst of the result of an analysis or examination of the
or on receipt of a report of an analyst of the result of an analysis or examination of the 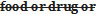 sample, is of the opinion that the sale of the food or drug in Canada would constitute a violation of the Act or these Regulations, the inspector shall […].
sample, is of the opinion that the sale of the food or drug in Canada would constitute a violation of the Act or these Regulations, the inspector shall […]. - (FR) L’inspecteur qui estime, après examen d’un échantillon de l’aliment ou de la drogue ou réception du rapport de l’analyste que la vente de l’aliment ou de la drogue
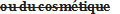 serait contraire à la Loi ou au présent règlement,
serait contraire à la Loi ou au présent règlement,  en avise […].
en avise […].
- (EN)
- B.21.003b) : La traduction incorrecte du mot « glaze » (actuellement « lustre ») sera changée pour « glaçure ».
- B.21.005 : Les mots « d’animaux marins ou d’animaux d’eau douce ou leurs préparations » seront supprimés, de sorte que l’article fera simplement référence à la « chair ».
6. Corriger des erreurs dans les numéros de renvoi vers des dispositions :
- Il y a une erreur dans le renvoi vers les exigences relatives à la déclaration des réactions indésirables aux drogues destinées à un essai clinique dans le RAD, en raison de la nouvelle numérotation découlant de l’ajout des articles C.01.018 à C.01.020 dans le titre 1. Le renvoi figurant au paragraphe C.05.014(3) sera modifié de sorte que « C.01.016 and C.01.017 » sera remplacé par « C.01.016 to C.01.020 » dans la version anglaise et que « C.01.016 et C.01.017 » sera remplacé par « C.01.016 à C.01.020 » dans la version française.
- À l’alinéa C.01A.013a), la référence aux « sous-alinéas C.01A.005g)(i) ou (ii) » est erronée, étant donné que l’alinéa (g) ne contient plus de sous-alinéas. L’alinéa C.01A.013a) sera modifié de façon à ne faire référence qu’à l’alinéa C.01A.005g).
7. Abroger des dispositions désuètes ou actualiser des références désuètes ou des expressions archaïques :
- Le langage archaïque utilisé à l’article C.01.009 du RDA sera modernisé en remplaçant « statute of the Parliament of Canada » par « Act of Parliament » dans la version anglaise, et en remplaçant « un statut du Parlement du Canada » par « une loi fédérale » et « d’un statut » par « d’une telle loi » dans la version française.
Les modifications apportées au RIM consistent à :
1. Abroger des dispositions désuètes ou actualiser des références désuètes ou des expressions archaïques :
- Les alinéas 5a) et 5b) du RIM seront abrogés, car ce sont des normes obsolètes. Les gazoducs médicaux seront dorénavant réglementés par les codes nationaux et provinciaux du bâtiment, car ils font partie de la structure d’un hôpital. Les autorités de réglementation du Ministère excluent du Règlement sur les instruments médicaux les gazoducs médicaux qui font partie de la structure d’un hôpital.
Les modifications apportées au RS consistent à :
1. Abroger le paragraphe 28(1), puisque les exigences en matière d’étiquetage qu’il prévoit sont devenues redondantes à la suite de modifications apportées au RAD en 2013.
- La Loi réglementant certaines drogues et autres substances (LRCDAS) et ses règlements d’application, y compris le RS, fournissent un cadre pour le contrôle des substances qui peuvent altérer les processus mentaux et nuire à la santé et à la société lorsqu’elles sont détournées ou mal utilisées. Dans ce contexte, le paragraphe 28(1) du RS prévoit ce qui suit :
- « Il est interdit au distributeur autorisé de vendre ou de fournir tout stupéfiant qui n’est pas une drogue au sens de l’article 2 de la Loi sur les aliments et drogues sauf si le stupéfiant est étiqueté conformément au Règlement sur les aliments et drogues. »
- Le paragraphe 28(1) visait à garantir que les stupéfiants prenant la forme d’ingrédients actifs pharmaceutiques (et non seulement des produits médicamenteux finis) soient étiquetés conformément au Règlement sur les aliments et drogues (RAD). Cependant, en raison de modifications apportées au RAD en 2013, le paragraphe 28(1) du RAD n’est plus nécessaire, car les matières premières (c’est-à-dire les ingrédients pharmaceutiques actifs) font maintenant l’objet d’exigences en matière d’étiquetage qui sont énumérées dans le RAD.
- L’article 59 du RS prévoit que le ministre peut donner un avis à certaines autorités (par exemple producteurs autorisés, autorité attributive de licences en matière de santé) s’il a des motifs raisonnables de croire qu’un praticien de la santé a enfreint certaines dispositions du RACFM. L’article 59 fait référence à ces dispositions du RACFM en indiquant qu’elles se trouvent aux articles 128, 129 et 130. Or, ces numéros correspondent aux articles dans lesquels se trouvaient les dispositions en question dans l’ancien Règlement sur la marihuana à des fins médicales (RMFM). Dans le RACFM, ces dispositions se trouvent aux articles 7, 8 et 9. Les modifications proposées permettront de corriger ces renvois dans l’article 59 du RS.
Le RACFM sera modifié afin de corriger les erreurs de numérotation relevées aux articles suivants :
1. Article 88
- Cet article vise à permettre aux producteurs autorisés de combiner sur une même étiquette les renseignements sur le produit et les renseignements concernant le client, pour tous les produits. Les exigences en matière d’étiquetage pour ce qui touche les renseignements sur le produit et les renseignements sur le client diffèrent selon le produit vendu ou fourni, soit d’une part la marihuana fraîche ou séchée et l’huile de chanvre indien et, d’autre part, les graines et plants de marihuana.
- Les exigences en matière d’étiquetage qui visent les graines et les plants de marihuana sont énoncées aux articles 85 et 86, respectivement. L’article 87 précise les exigences en matière d’étiquetage qui se rapportent aux renseignements concernant le client.
- Le libellé actuel du Règlement ne permet pas aux producteurs autorisés d’apposer sur une même étiquette les renseignements concernant le client et les renseignements sur le produit lorsqu’il s’agit de graines et de plants de marihuana (alors qu’ils peuvent le faire lorsqu’il s’agit de marihuana fraîche ou séchée, ou d’huile de chanvre indien), parce que l’article 88 ne fait pas référence aux articles 85 et 86. Ce n’est toutefois pas l’intention de cette disposition. Les modifications proposées corrigeront cette incohérence dans le Règlement en permettant aux producteurs autorisés de combiner sur une même étiquette les renseignements concernant le client et les renseignements sur le produit pour les graines et les plantes de marihuana, comme c’est le cas pour la marihuana fraîche ou séchée et l’huile de chanvre indien.
2. Article 90
- Cet article du RACFM exige que tous les renseignements se trouvant sur l’étiquette de produit, pour la marihuana fraîche ou séchée et l’huile de chanvre indien, et sur l’étiquette concernant le client, pour la marihuana fraîche ou séchée, l’huile de chanvre indien, les graines de marihuana et les plants de marihuana, figurent en anglais et en français, soient clairement présentés et placés bien en vue sur l’étiquette et soient faciles à apercevoir dans les conditions habituelles d’usage. Les modifications proposées feront en sorte que ces exigences s’appliquent également aux renseignements figurant sur l’étiquette de produit des graines et des plants de marihuana, et élimineront ainsi l’incohérence relevée entre les produits.
Règle du « un pour un »
La règle du « un pour un » ne s’applique pas à ces modifications, car celles-ci n’entraînent pas de changement dans les coûts administratifs encourus par les entreprises.
Lentille des petites entreprises
La lentille des petites entreprises ne s’applique pas à ces modifications, car aucun coût n’est imposé aux petites entreprises.
Justification
Certaines des modifications apportées au RAD font suite à l’examen du Règlement par le Comité mixte permanent d’examen de la réglementation. Le Ministère a également signalé un certain nombre de modifications de forme mineures à apporter au RAD (harmonisation entre les libellés, correction d’erreurs de renvois et d’erreurs typographiques, actualisation de renvois désuets ou d’expressions archaïques) et au RIM (abrogation de dispositions désuètes). Ces modifications permettent de corriger ou d’améliorer le fondement réglementaire sans toutefois imposer de coûts à l’État ou aux intervenants.
L’abrogation du paragraphe 28(1) du RS répond à une préoccupation soulevée par le CMPER. Cette disposition n’est plus nécessaire depuis l’entrée en vigueur du Règlement modifiant le Règlement sur les aliments et drogues (1475 — bonnes pratiques de fabrication) publié en mai 2013. La modification de 2013 a élargi la portée de certaines dispositions du RAD se rapportant aux exigences en matière d’étiquetage de manière à ce que les dispositions s’appliquent à la fois aux ingrédients actifs et aux produits finis. Les exigences du paragraphe 28(1) du RS en matière d’étiquetage ne sont plus requises.
Les modifications apportées au RACFM et au RS permettent de corriger les erreurs contenues dans les textes réglementaires et d’assurer la cohérence et la clarté du cadre de réglementation du cannabis utilisé à des fins médicales, sans toutefois imposer de coûts à l’État et aux intervenants.
Personnes-ressources
Nancy Maguire
Gestionnaire
Affaires réglementaires du Ministère
Direction générale des opérations réglementaires et des régions
Santé Canada
Indice de l’adresse : 3005A
Édifice Holland Cross, tour B, 5e étage
11, avenue Holland
Ottawa (Ontario)
K1A 0K9
Courriel : DRA-ARM@hc-sc.gc.ca
Modifications apportées au RAD et au RIM :
Bruno Rodrigue
Directeur
Bureau de la modernisation des lois et des règlements
Direction des politiques, de la planification et des affaires internationales
Direction générale des produits de santé et des aliments
Santé Canada
Indice de l’adresse : 3000A
Édifice Holland Cross, tour A, bureau 14
11, avenue Holland
Ottawa (Ontario)
K1A 0K9
Courriel : LRM_MLR_consultations@hc-sc.gc.ca
Modifications apportées au RACFM :
Bureau de l’accès médical au cannabis
Santé Canada
Indice de l’adresse : 0302B
Ottawa (Ontario)
K1A 0K9
Courriel : OMC-Engagement-BCM@hc-sc.gc.ca
Modifications apportées au RS :
Denis Arsenault
Gestionnaire
Direction générale de la santé environnementale et de la sécurité des consommateurs
Santé Canada
Immeuble principal de Statistique Canada
150, promenade du Pré Tunney
Ottawa (Ontario)
K1A 0K9
Courriel : OCS_regulatorypolicy-BSC_ politiquereglementaire@hc-sc.gc.ca
- Référence a
L.C. 2012, ch. 19, art. 414 - Référence b
L.R., ch. F-27 - Référence c
L.C. 2015, ch. 22, par. 4(1) - Référence d
L.C. 1996, ch. 19 - Référence 1
C.R.C., ch. 870 - Référence 2
DORS/98-282 - Référence 3
DORS/2014-158 - Référence 4
C.R.C., ch. 1041 - Référence 5
DORS/2016-230